
Introducción
La recuperación de metales provenientes de residuos industriales, de la construcción y urbanos es llamada “minería urbana”. Se trata de un proceso por el cual se recuperan metales tales como Au, Pt, Mn, Ti, Fe, Zn, Co, Ni, Li, Cu, y Al provenientes de desechos como Residuos de Aparatos Eléctricos y Electrónicos (RAEE) (pilas alcalinas, baterías de ion Li, etcétera), cenizas volantes, lodos de alto horno, polvos siderúrgicos, autopartes de automóviles, polvos de aspiración de horno eléctrico de arco, finos de residuo de proceso Shredder, entre otros. Se han propuesto diferentes tecnologías con el objetivo de mejorar la extracción de metales pesados, entre ellas, la biolixiviación y la lixiviación alcalina (Dutra et al., 2006; Lewis et al., 2011).
En las últimas décadas, el consumo de pilas alcalinas y Zn/C ha aumentado y su eliminación final representa un problema ambiental cada vez mayor. Las pilas agotadas son residuos peligrosos, debido a la presencia de metales pesados. El ánodo de las pilas alcalinas está compuesto por una mezcla de ZnO y Zn (OH)2 y podría ser utilizado como materia prima para la síntesis de ZnO.
El óxido de zinc (ZnO) se ha transformado en un material tecnológico clave, como resultado de la combinación de sus propiedades estructurales y optoelectrónicas. El ZnO es un semiconductor con una energía de gap de 3.37 eV, lo cual permite su uso en aplicaciones optoelectrónicas de onda corta. También, es transparente a la luz visible y su conductividad puede modificarse mediante el dopaje con distintos elementos. Por último, pueden obtener materiales con diferentes morfologías (nanoagujas, nanoflores, nanohélices, nanobelts, etcétera) mediante la variación de las condiciones de crecimiento (Zhong et al., 2004). Las propiedades mencionadas hasta aquí lo convierten en un material versátil. Sus principales usos son en la industria del caucho y de la cerámica; fluidos de perforación para la industria del petróleo y el gas; LED; transistores transparentes; células solares y dispositivos de memoria. El ZnO de tamaño nanométrico muestra actividad antibacteriana significativa en un amplio espectro de especies bacterianas estudiadas, de acuerdo a lo reportado por diferentes autores (Brayner et al., 2006; Jones et al., 2008; Jalal et al., 2010; Seil et al., 2012).
Existen trabajos publicados que han señalado la actividad antibacteriana, antifúngica e inactivación viral de este material a escala nanométrica, considerada no tóxico para las células humanas (Sirelkhatim et al., 2015).
En tal sentido, hay tres mecanismos básicos responsables de la actividad antimicrobiana:
- La producción de especies reactivas de oxígeno debido a sus propiedades semiconductoras. En este sentido, el peróxido de hidrógeno (H2O2) generado por las partículas de ZnO podría ser la razón principal de su actividad antimicrobiana (Ogunsona et al., 2020).
- La desestabilización por interacciones del tipo electrostático entre las membranas de las células microbianas (generalmente, con carga negativa) con las partículas de ZnO que presentan carga positiva en suspensión acuosa (Zhang et al., 2008).
- La liberación de iones Zn2+ que interferiría con el metabolismo celular al interactuar con su sistema enzimático (Sirelkhatim et al., 2015).
Varias publicaciones señalan que las propiedades de las NP de ZnO dependen fuertemente del proceso de obtención que afecta sus características superficiales, estructurales, morfológicas y de tamaño (Ahmed et al., 2017; da Silva et al., 2019). Por lo tanto, el estudio de NP de ZnO obtenidas por distintas metodologías, partiendo de distintas materias primas, abre un abanico de posibilidades tendientes a la obtención de productos más eficientes en cuanto a sus potencialidades antimicrobianas. En este contexto, el presente trabajo se propone evaluar el uso de ZnO obtenido del reciclado de pilas alcalinas en la formulación de pinturas bioactivas eficientes en la prevención del crecimiento de hongos.
Materiales y métodos
Obtención de ZnO a partir de pilas alcalinas agotadas
El Zn presente en las pilas alcalinas agotadas fue recuperado mediante un proceso de lixiviación ácida, para esto se usó H2SO4 biogenerado. Tanto el acopio de las pilas como la producción del ácido se llevaron a cabo en la Planta Piloto Multipropósito (PlaPiMu-LaSeISiC, CICPBA) de la ciudad de La Plata. Luego del proceso de lixiviación se obtiene una solución conteniendo iones Zn+2, mediante el agregado de H2C2O4 y Na2CO3 se obtuvieron dos sólidos, tal como describe María V. Gallegos et al. (2018). Los materiales obtenidos se denominaron: O-ZnO y C-ZnO, respectivamente.
Para el estudio de la eficiencia antimicrobiana se realizaron ensayos usando los sólidos mencionados anteriormente y un óxido de zinc comercial.
Evaluación de la actividad antifúngica
La evaluación de las potencialidades antifúngicas de los óxidos en estudio se realizó, en primer lugar, mediante una de las variantes de la técnica de difusión en agar (KirbyBauer) con base en lineamientos del Clinical and Laboratory Standards Institute. Las cepas fúngicas utilizadas fueron Chaetomium globosum (KU936228) y Aspergillus fumigatus (KU936230) aisladas a partir de películas de pintura biodeterioradas en trabajos previos (Deyá & Bellotti, 2017). A partir de cultivos en placa se obtuvieron los inóculos (105 esporas / mL) mediante la remoción de las esporas con la ayuda de un ansa estéril y solución fisiológica (SF). Se prepararon placas con 15 mL de medio de cultivo agarizado con base en extracto de malta (MEA) inoculado con 200 μL de la suspensión de esporas. Luego en cada placa, se realizaron tres hoyos de 7 mm de diámetro con la ayuda de un sacabocado metálico estéril donde se introdujeron 20 mg de cada uno de los sólidos evaluados: ZnOc (comercial), O-ZnO y C-ZnO. También se realizaron controles con 20 mg de agua destilada.
El procedimiento fue realizado por triplicado para cada sólido. Finalmente, las placas fueron incubadas por 48 h a 30 °C. Al terminar el ensayo se midieron los diámetros de los halos de inhibición. Las muestras fueron consideradas como activas o no activas según los diámetros resultaran > 7 mm o < 7 mm, respectivamente. Diámetros = 7 mm (sin halo de inhibición) se consideraron parcialmente activas teniendo en cuenta el tipo de crecimiento invasivo que desarrollan los hongos filamentosos. Se tomaron registros fotográficos y se realizaron observaciones mediante un microscopio estereoscópico (Leica S8 APO).
Ensayo de inhibición en placa
A partir de los resultados obtenidos en la etapa previa se seleccionaron los óxidos que resultaron activos frente al mayor número de cepas. Con el objetivo de profundizar el estudio de estos compuestos en relación con su aplicación en la formulación de pinturas es que se realizó el ensayo de inhibición del crecimiento fúngico en placa (Bellotti et al., 2013)
Se prepararon placas con 15 mL de MEA con concentraciones de 0.1, 0.2, 0.3, 0.5, 1 y 1.5 % (p/v) de los óxidos en estudio, además de los controles que contenían solo medio de cultivo. Cada placa fue inoculada en el centro mediante 20 μL de inóculo, utilizando las mismas cepas que en el ensayo previo. El ensayo fue realizado por triplicado. Las placas fueron incubadas a 30 °C por 7 días. Se midieron los diámetros de crecimiento en cada placa al 1.°, 4.° y 7.° día. Con los datos obtenidos se calculó el porcentaje de inhibición (%I) y se determinó la concentración inhibitoria mínima (CIM) aquella donde el % I fue total.
Formulación, preparación y caracterización de las pinturas
La composición utilizada para la preparación de la pintura se basó en una formulación convencional para una pintura de interior según Barberia-Roque (et al., 2019): 48,0 % de agua, 28,8 % CaCO3, 13,0 % de TiO2, 6.0 % resina acrílica y 4.1 % aditivos (antiespuma, espesante celulósico, regulador de pH, dispersante y coalescente); los porcentajes refieren a g/100g pintura. Todos los componentes fueron adquiridos en forma comercial. Sobre la base de la formulación mencionada se obtuvo la pintura control (PC) además de las pinturas con el óxido seleccionado con base en sus potencialidades antimicrobianas. Para la obtención de las pinturas experimentales se reemplazó en peso uno de los pigmentos (CaCO3) para obtener distintas concentraciones (1,5 % y 2 %) del biocida experimental en relación con el total de pintura. Las pinturas se prepararon en una dispersora de alta velocidad situada en la planta piloto del Centro de Investigación y Desarrollo en Tecnología de Pinturas (CIDEPINT).
Las pinturas fueron caracterizadas. Se midió el color y el brillo mediante los parámetros de color CIElab utilizando un equipo ByK-Gardner gloss-meter, siguiendo la misma metodología de Deyá y Bellotti, 2017. Se determinó la absorción de agua (% p/p) siguiendo un procedimiento similar al de la Norma ASTM D570 y la permeabilidad al agua mediante el “método del embudo”. La viscosidad fue determinada siguiendo los lineamientos de la Norma ASTM D562 mediante el uso de un viscosímetro Stormer. Se obtuvo el grado de dispersión de las muestras de pintura líquida mediante el uso de un grindómetro, también se determinó el peso específico y el poder cubritivo según la Norma IRAM 1109.
Evaluación de la resistencia al biodeterioro de las pinturas
Las pinturas fueron evaluadas en cuanto a su resistencia al crecimiento de hongos mediante un ensayo en placa siguiendo una metodología basada en la norma ASTM D 5590 (Bellotti et al., 2013). Las pinturas se aplicaron en portaobjetos de vidrio que luego fueron secados en condiciones de laboratorios y descontaminados mediante una lámpara UV- germicida (Philips, 20 W). Las muestras se dispusieron en placas con medio mineral mínimo y fueron inoculadas con 50 μL de suspensión de esporas (105 esporas/mL) de las mismas cepas usadas en los ensayos previos. En total se ensayaron 6 muestras de cada pintura. Las placas fueron incubadas durante un mes a 30°C. Al finalizar el ensayo las muestras se evaluaron por observación directa y mediante el uso de un microscopio estereoscópico. Para calificar el desempeño de las pinturas se utilizó una escala de 0 a 4, referida a distintos grados de crecimiento (sin crecimiento, escaso, ligero, moderado y abundante) según el área cubierta basada en la norma ASTM D 5590.
Resultados y discusión
Evaluación de la actividad antifúngica
Los diámetros promedio y la desviación estándar de los halos de inhibición obtenidos a partir del ensayo de difusión en agar se muestran en la Tabla 1. Imágenes obtenidas mediante microscopía de las muestras estudiadas pueden observarse en la Figura 1. En el caso del ensayo frente a C. globosum, ZnOc y O-ZnO, presentaron comportamientos similares al registrado en los controles, donde pudo observarse crecimiento por dentro del diámetro de los hoyos (<7 mm), siendo consideradas no activas frente a la cepa en estudio. El caso contrario ocurrió con C-ZnO que mostró halos de inhibición importantes con diámetros > 7 mm.
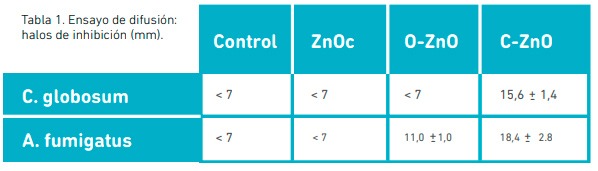
En el caso del ensayo frente a A. fumigatus, C-ZnO mostró resultados similares a los obtenidos con C. globosum; O-ZnO resultó activo también frente a esta cepa a diferencia de lo ocurrido con C. globosum. Al comparar la bioactividad de los tres óxidos evaluados teniendo en cuenta el ensayo de difusión en agar, se pudo inferir que C-ZnO resultó ser el más activo en las condiciones de ensayo al inhibir el crecimiento de ambas cepas fúngicas a diferencia de los otros (ZnOc y O-ZnO).

En la síntesis de nuevos materiales es importante el análisis de sus características estructurales y morfológicas lo cual puede vincularse a la actividad antimicrobiana exhibida por los óxidos en estudio. Las caracterizaciones fisicoquímicas de los sólidos recuperados y de referencia (ZnOc) realizadas por Gallegos (et al. 2018) puede aportar en la explicación del comportamiento observado en el ensayo microbiológico. En tal sentido, C-ZnO ha mostrado tener mayor cantidad de monovacancias de oxígeno, además de un menor tamaño de partícula en comparación con O-ZnO y ZnOc, lo cual favorecería la disponibilidad de los iones Zn2+ para su interacción con las células microbianas. Teniendo en cuenta que el objetivo era seleccionar un ZnO producto del reciclado de las pilas alcalinas, aplicable como aditivo antifúngico en la formulación de pinturas, y que entre los óxidos estudiados el C-ZnO probó ser el de más amplio espectro de bioactividad, fue el seleccionado para continuar en la siguiente etapa.
Ensayo de inhibición en placa
Antes de proceder con la formulación de las pinturas se estudió el efecto inhibitorio del óxido seleccionado (C-ZnO) frente a las cepas fúngicas en relación con la concentración en condiciones controladas en medio sólido.
En tal sentido, se realizó el ensayo de inhibición en placa que frente a C. globosum, con concentraciones menores (0,1, 0,2 y 0,3 %) de C-ZnO, presentaron un crecimiento similar al del control durante los 7 días del ensayo (I% = 0). Las placas con concentraciones de 0,5, 1,0 y 1,5 % presentaron un comportamiento distinto a las mencionadas antes, como puede verse en la Figura 2a. En las placas de concentración 0,5 % se observó un crecimiento lento en el transcurso de los días que se redujo aún más con 1,0 % mientras que con 1,5 % de C-ZnO la inhibición fue total (% I = 100).
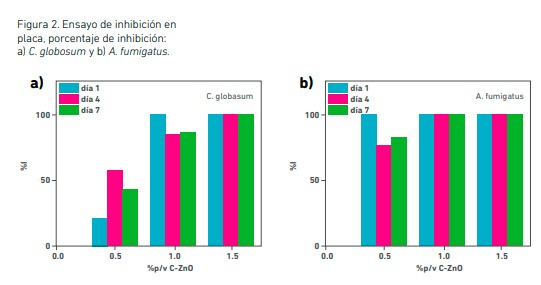
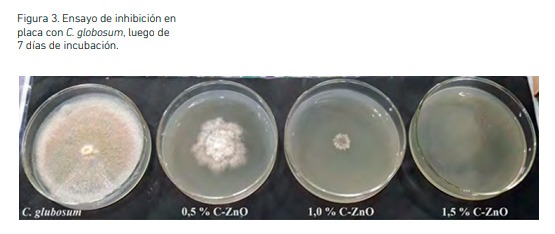
Frente a A. fumigatus, concentraciones menores a 0,5 % mostraron resultados similares a los de C. globosum, a excepción de 0,3 % que en el primer día exhibió un 100 % de inhibición, pero en el transcurso de los días eso fue variando y evidenciándose el crecimiento fúngico, aunque en forma muy lenta. En la Figura 2b pueden observarse los % I obtenidos frente a A. fumigatus con las concentraciones mayores, donde se evidencia la inhibición total con 1 y 1,5 % de C-ZnO. Registros fotográficos obtenidos al final del ensayo se pueden observar en las figuras 3 y 4. En el caso de las placas con 1,5 % de C-ZnO no mostraron crecimiento alguno al cabo de los 7 días que duró el ensayo (Figura 3). Por lo tanto, esta concentración resulta la denominada concentración inhibitoria mínima (CIM) para esta cepa, teniendo en cuenta el rango de concentraciones ensayadas
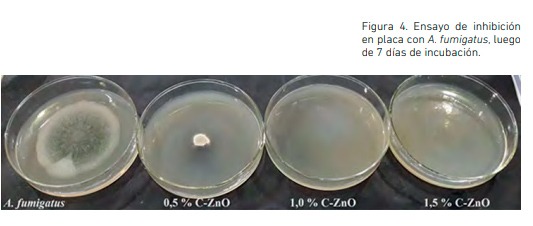
El crecimiento de A. fumigatus se redujo de forma considerable, particularmente, en las concentraciones de 1,0 y 1,5 %, donde se constató un 100 % de inhibición en los 7 días de ensayo como puede observarse en la Figura 4. En general, A. fumigatus resultó más sensible en comparación a C. globosum, dado que su crecimiento se vio más inhibido a concentraciones menores. En tal sentido, la CIM para este caso (1,0 %) fue menor en relación con la obtenida frente a C. globosum (1,5 %).
Cabe destacar que en ambos casos se observó una relación directamente proporcional entre la concentración y el grado de inhibición. Teniendo en cuenta lo mencionado, se decidió que la concentración mínima contemplada para la formulación de las pinturas a evaluar sería de 1,5 % de C-ZnO (por ser la concentración que inhibe el crecimiento en un 100 % a ambas cepas en estudio).
Formulación, preparación y caracterización de las pinturas
Se prepararon pinturas con la composición base presentada previamente, reemplazando en peso una parte de uno de los pigmentos (CaCO3) por el C-ZnO, de forma tal que la concentración total del mismo en la pintura fuera de 1,5 y 2,0 g por cada 100 g de pintura. Estas concentraciones se presentan dentro del rango utilizado para los aditivos de pinturas. Por otro lado, se preparó una pintura control sin agregado de ningún biocida. Las pinturas fueron rotuladas como Pintura control, 1,5 % C-ZnO y 2,0% C-ZnO. Se evaluó el impacto del agregado de C-ZnO en la pintura mediante su caracterización.
Se determinó el cambio de color (ΔE) y brillo mediante la medición de los parámetros de color CIElab (L, a y b). El ΔE de la pintura debido al agregado de C-ZnO resultó 0,4. Este ΔE se relaciona con un cambio en la apariencia visual “muy débil” por lo que se concluye que el agregado del ZnO en estudio no produjo cambios significativos en el color en relación con la pintura control. En cuanto al brillo no se observan cambios entre ambas pinturas y los valores se encuentran entre las especificaciones de la Norma IRAM 1070 para pinturas de interior.
Los resultados obtenidos de las determinaciones de absorción de agua y permeabilidad al agua se muestran en la Tabla 2. La absorción de agua exhibida por la pintura con el agregado de C-ZnO fue mayor a la obtenida a partir de la pintura control, mientras que la permeabilidad fue menor. La permeabilidad luego de las primeras 24 h resultó de 0,19 g/cm2 para la pintura control y 0,15 g/cm2 para la pintura con ZnO; esta tendencia se mantuvo a las 48 h y las 72 h. Las diferencias registradas en la absorción y la permeabilidad podrían deberse a que las partículas de C-ZnO de menor tamaño se distribuyen entre las de los pigmentos de tamaño micrométrico (TiO2 y CaCO3 ) generando una conformación diferente en la película comparada a la pintura control. Esta nueva disposición en el recubrimiento aumentaría el área superficial de los sólidos dentro de la película. En este punto, es importante recordar que, en una formulación, existen componentes volátiles y otros no volátiles. Los primeros se eliminan durante el proceso de secado/curado y los no volátiles son los que conforman la película seca de pintura, siendo responsables de las propiedades finales de la misma (Yebra et al., 2009). En tal sentido, el tamaño y forma de las partículas afectan la distribución espacial y la superficie expuesta de los componentes, lo cual, impacta en las propiedades de la película.
Dos propiedades específicas de la pintura líquida, como son la viscosidad y el peso específico, no mostraron diferencias entre una y otra formulación, como se presenta en la Tabla 2. Cabe destacar que estos valores, junto con el grado de dispersión presentado por la pintura control, se encuentran dentro de los rangos requeridos por la Norma IRAM 1070. En cuanto al grado de dispersión mostrado por la pintura con C-ZnO, resultó menor respecto a la pintura control. Esto estaría relacionado con cierta aglomeración experimentada por las partículas integradas en el sistema.
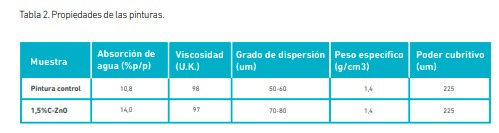
En relación con el poder cubritivo, el ocultamiento visual del damero se logró en ambas pinturas mediante un espesor de 225 µm aplicado en húmedo, en tres capas de 75 µm y secado de 24 h entre capas. En este sentido, se reportó entre 99 y 100 % de poder cubritivo para ambas pinturas analizadas con los distintos espesores obtenidos por capa (75, 150 y 225 µm). Esto último fue determinado por reflectometría, por relación de contraste.
De estas determinaciones se desprende que el agregado del óxido estudiado en la concentración correspondiente no alteró propiedades específicas como el color, el brillo, la viscosidad, el peso específico y el poder cubritivo de la pintura.
Evaluación de la resistencia al biodeterioro de las pinturas
En la Figura 5 se muestran registros fotográficos de muestras de pintura luego de un mes de exposición al crecimiento de las cepas en estudio.
En el caso de las películas inoculadas con C. globosum que se muestran en la Figura 5a, las muestras de pintura control presentaron un crecimiento apreciable en la superficie de las películas calificado como 3 (moderado). Las muestras de pinturas correspondientes a 1,5 % C-ZnO presentaron un crecimiento escaso, por lo que la calificación correspondiente fue 1. Mientras que las muestras de 2 % de C-ZnO mostraron aún menor grado de crecimiento por lo que su calificación fue de 0-1.
Pinturas inoculadas con A. fumigatus son exhibidas en la Figura 5b. Las muestras de pintura control mostraron un crecimiento muy abundante, calificado con 4. Por otro lado, las muestras correspondientes a 1,5 % de C-ZnO presentaron un crecimiento entre escaso y ligero, mayormente observable en los bordes como puede verse en la figura, calificado como 1-2. En el caso de las muestras de pinturas 2 % de C-ZnO se observó un crecimiento menor, evaluado como escaso y calificado con 1.

Finalmente, la pintura de 2% C-ZnO resultó la más eficiente en impedir el biodeterioro frente a las cepas fúngicas dado que obtuvo los mejores resultados en el ensayo de resistencia con un crecimiento calificado entre nulo y escaso.
Conclusión
Fue posible, mediante un proceso biohidrometalúrgico, recuperar Zn2+ de pilas alcalinas agotadas y, a partir de este, mediante la precipitación con H2 C2 O4 y Na2 CO3 obtener dos sólidos (C-ZnO y O-ZnO) con propiedades ópticas, eléctricas y texturales diferentes. Estas variaciones se vieron reflejadas en las potencialidades antifúngicas de dichos materiales. En tal sentido, C-ZnO presentó actividad frente a las dos cepas fúngicas utilizadas en los bioensayos a diferencia de O-ZnO, siendo el menos activo el ZnO comercial. Los resultados observados podrían relacionarse con que el sólido C-ZnO presenta mayor cantidad de monovacancias de oxígeno y menor tamaño de partícula. Esas particularidades, favorecerían la disponibilidad de los iones Zn2+ para su interacción con las células microbianas. Por otro lado, C-ZnO logró inhibir en un 100 % el crecimiento en placa de ambas cepas fúngicas con una concentración de 1,5 % p/v.
Fue posible obtener pinturas integrando C-ZnO en su composición en forma eficiente, manteniendo la estabilidad del sistema disperso sin modificar en forma sustancial sus propiedades específicas. Estas pinturas probaron ser bioactivas al inhibir el crecimiento de los hongos inoculados. Los resultados obtenidos muestran que es posible obtener nuevos materiales a partir de residuos perjudiciales, tanto para la salud humana como para el ambiente. En tal sentido, representan una solución a grandes problemas ambientales y se alinean con los Principios de la Química Verde.
Agradecimientos
Los autores agradecen al Consejo Nacional de Investigaciones Científicas y Técnicas (CONICET), a la Comisión de Investigaciones Científicas de la Provincia de Buenos Aires (CICPBA), a la Agencia Nacional de Promoción Científica y Tecnológica (ANPCyT) y a la Universidad Nacional de La Plata (UNLP). Asimismo, los autores agradecen al sector de servicios del CIDEPINT, especialmente, al Ing. Mateo Paez y al Tco. Diego Tunessi
Referencias
– Ahmed, S., Annu, Chaudhry, S. A. y Ikrama, S. (2017). A review on biogenic synthesis of ZnO nanoparticles using plant extracts and microbes: A prospect towards green chemistry. Journal of Photochemistry & Photobiology, B: Biology. 166, 272-284. https://doi.org/10.1016/j. jphotobiol.2016.12.011
– Barberia-Roque, L., Gámez-Espinosa, E., Viera, M. y Bellotti, N. (2019). Assessment of three plant extracts to obtain silver nanoparticles as alternative additives to control biodeterioration of coatings. International Biodeterioration & Biodegradation, 141, 52-61 https://doi.org/10.1016/j. ibiod.2018.06.011
– Bellotti, N., Romagnoli, R., Quintero, C., DomínguezWong, C., Ruiz F. y Deyá C. (2015). Nanoparticles as antifungal additives for indoor water borne paints. Progress in Organic Coatings, 86, 33-40. https:// doi:10.1016/j.porgcoat.2015.03.006
– Brayner, R., Ferrari-Iliou, R., Brivois, N., Djediat, S., Benedetti M. F. y Fiévet, F. (2006). Toxicological Impact Studies Based on Escherichia coli Bacteria in Ultrafine ZnO Nanoparticles Colloidal Medium. Nano Lett, 6(4), 866–870 (2006). https://doi.org/10.1021/nl052326h
– Da Silva, B. L., Caetano, B. L., Chiari-Andréo, B. G., Rodrigues Pietro, R. C. L. y Leila Aparecida Chiavaccia, L. A. (2019). Increased antibacterial activity of ZnO nanoparticles: Influence of size and surface modification. Colloids and Surfaces B: Biointerfaces, 177, 440-447. https://doi. org/10.1016/j.colsurfb.2019.02.013
– Deyá, D. y Bellotti, N. (2017). Biosynthesized silver nanoparticles to control fungal infections in indoor environments. Advances in Natural Sciences: Nanoscience and Nanotechnology, 8(2), 025005. http://dx.doi. org/10.1088/2043-6254/aa6880
– Dutra A., Paiva P. y Tavares M. L. (2006). Alkaline leaching of zinc from electric arc furnace steel dust. Minerals Engineering, 19, 478–485. https://doi.org/10.1016/j.mineng.2005.08.013 Gallegos, M.V., Aparicio F., Peluso, M. A., Damonte, L.C. y Sambeth J. E. (2018). Structural, optical and photocatalytic properties of zinc oxides obtained from spent alkaline batteries. Materials Research Bulletin, 103, 158-165. https://doi.org/10.1016/j.materresbull.2018.03.022
– Jalal, R., Goharshadi, E. K., Abareshi, M., Moosavi, M., Yousefi, A. y Nancarrow, P. (2010). ZnO nanofluids: Green synthesis, characterization, and antibacterial activity Materials Chemistry and Physics, 121(1-2), 198–201. https://doi.org/10.1016/j.matchemphys.2010.01.020
– Jones, N., Ray, B., Ranjit, K. T. y Manna, A. C. (2008). Antibacterial activity of ZnO nanoparticle suspensions on a broad spectrum of microorganisms. FEMS Microbiol Lett, 279(1), 71–76. https://doi.org/10.1111/j.1574- 6968.2007.01012.x
– Lewis G., Gaydardzhiev, S., Bastin O. y Bareel, P. (2011). Bio hydrometallurgical recovery of metals from Fine Shredder Residues. Minerals Engineering, 24(11), 1166- 1171. https://doi.org/10.1016/j.mineng.2011.03.025
– Ogunsona, E. O., Muthuraj, R., Ojogbo, E., Valerio, O., Mekonnen, T. H. (2020). Engineered nanomaterials for antimicrobial applications: A review. Applied Materials Today, 18, 100473. https://doi.org/10.1016/j. apmt.2019.100473 – Seil, J. T. y Webster, T. J. (2012). Antimicrobial applications of nanotechnology: methods and literature. Int J Nanomedicine, 7, 2767–2781. https://doi.org/10.2147/IJN.S24805
– Sirelkhatim, A., Mahmud, S., Seeni, A., Kaus, N. H. M., Ann, L. C., Bakhori, S. K. M., Hasan, H. y Mohamad, D. (2015). Review on Zinc Oxide Nanoparticles: Antibacterial Activity and Toxicity Mechanism. Nano-Micro Letters, 7, 219-242. https://doi.org/10.1007/s40820-015-0040-x
– Yebra, D. M. y Weinell, C. E. (2009). Key issues in the formulation of marine antifouling paints. En C. Hellio y D. Yebra (Eds.), Advances in marine antifouling coatings and technologies (pp. 308-333). Reino Unido: Woodhead Publishing Limited.
– Zhang, L., Ding, Y., Povey, M. y York, D. (2008). ZnO nanofluids – A potential antibacterial agent. Progress in Natural Science, 18, 939-944. https://doi.org/10.1016/j. pnsc.2008.01.026
– Zhong Lin Wang. (2004). Zinc oxide nanostructures: growth, properties and applications. Journal of Physics: Condensed Matter, 16(25), 829–858. https://doi. org/10.1088/0953-8984/16/25/R01
Fuente: Ambiente en Diálogo
Por: Guillermo P. López
Centro de Investigación y Desarrollo en Tecnología de Pinturas – CIDEPINT CIC-CONICET-UNLP | Argentina
María V. Gallegos
Centro de Investigación y Desarrollo en Ciencias Aplicadas, “Dr. Jorge J. Ronco”CIC-CONICET-UNLP | Argentina
Natalia Bellotti
Centro de Investigación y Desarrollo en Tecnología de Pinturas – CIDEPINT CIC-CONICET-UNLP | Argentina
0 comentarios
Agregar comentario ×